Asam, basa dan garam (Plassa). Dalam kehidupan sehari-hari kita sering berhubungan dengan senyawa asam, basa dan garam, bahkan hampir tiap hari kita selalu menggunakan senyawa yang bersifat asam maupun basa. Kita pun tak lepas dari garam karena hampir semua makan yang kita makan menggunakan garam. Untuk memahami tentang asam, basa dan garam mari kita bahas bersama-sama.
A. Asam
Senyawa asam banyak kita jumpai pada kehidupan sehari-hari. Semua senyawa asam mempunyai rasa masam/kecut. Rasa masam/kecut ini desebabkan oleh adanya senyawa yang bersifat asam. Buah-buahan memiliki rasa asam berkat adanya senyawa asam yang dikandungnya. Jeruk mengandung asam sitrat sedangkan anggur mengandung asam tartrat. Air susu yang basi mengandung asam laktat. Selain itu, senyawa asam dapat kita temukan juga dalam lambung dan darah. Dalam lambung terdapat asam klorida yang berperan pada pencernaan makanan serta dalam darah terdapat asam karbonat dan asam phosfat yang berperan pada pengangkutan makanan. Perhatikan tabel berikut.
Tabel 1.1 Beberapa Asam dan Sumbernya
1. Ciri-Ciri Asam
a. Rasanya asam
b. Dapat mengubah warna kertas lakmus biru menjadi merah
c. Mempunyai pH (derajat keasaman) kurang dari 7
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dengan logam tertentu dapat mengahasilkan gas hidrogen
f. Bersifat korosif atau merusak bahan-bahan benda-benda yang dikenainya
2. Peranan Asam Dalam Kehidupan
Tabel 1.2 Beberapa Asam yang Ada di Sekitar
Meskipun asam adalah senyawa yang sangat berguna, tetapi asam juga dapat menimbulkan berbagai kerusakan pada bahan-bahan yang dikenainya karena asam bersifat korosif. Salah satunya adalah peristiwa hujan asam. Berikut adalah beberapa dampak yang ditimbulkan oleh hujan asam:
a. mungubah pH tanah sehingga kondisinya tidak sesuai dengan tumbuhan dan mengakibatkan pohon/tanaman mati.
b. dapat menghilangkan unsur-unsur hara dalam tanah sehingga mengurangi kesuburan tanah.
c. mengubah pH air sehingga dapat mematikan ikan-ikan dan biota-biota air.
d. merusak bangunan, terutama yang terbuat dari batu pualam (karbonat dan logam).
B. Basa
Seperti halnya asam, basa juga banyak kita jumpai dalam kehidupan sehari-hari. Para ibu rumah tangga menggunakan abu gosok untuk mencuci piring. Basa dalam abu gosok dapat bereaksi dengan kotoran berupa lemak/minyak , sehingga menjadi larut. Sedangkan, untuk mencuci piring yang sangat berminyak perlu menggunakan sabun. Sabun dapat melarutkan lemak dan minyak. Para penderita magh selalu minum obat berupa magnesium hidroksida atau aluminium hidroksida.
1. Ciri-Ciri Basa
a. Pahit dan licin di kulit
b. Mempunyai pH lebih dari 7
c. Mengubah warna lakmus merah menjadi biru
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dapat menetralkan sifat asam
f. Bersifat kausatik atau dapat merusak kulit
Gambar 1.1 Sabun merupakan salah satu contoh zat yang bersifat basa
2. Peranan Basa dalam Kehidupan
Tabel 1.3 Beberapa Basa dan Fungsinya
C. Teori Asam Basa Arrhenius
Dari uraian di atas, salah satu ciri dari asam adalah senyawa yang berasa asam dan memerahkan lakmus biru sedangkan basa adalah senyawa berasa pahit dan licin di kulit serta dapat membirukan lakmus merah. Ciri tersebut belum dapat menjelaskan mengapa asam atau basa dapat menghantarkan listrik atau dikenal dengan istilah elektrolit. Untuk itu, Svante August Arrhenius mengajukan suatu konsep asam-basa yang di kenal sebagai teori asam-basa Arrhenius.
Asam adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidrogen (H+). Semakin banyak ion H+, semakin kuat sifat asamnya. Dengan demikian, dikenal asam kuat dan asam lemah. Asam kuat dalam air terionisasi sempurna (semua terurai menjadi ion), sedangkan asam lemah terionisasi sebagian (tidak semua terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.4 Asam Kuat dan Reaksi Ionisasinya
Tabel 1.5 Beberapa Asam Lemah dan Reaksi Ionisasinya
Basa adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidroksida (OH-). Semakin banyak ion OH-, semakin kuat sifat basanya. Dengan demikian, dikenal basa kuat dan basa lemah. Basa kuat dalam air terionisasi sempurna (semua terurai menjadi ion), sedangkan basa lemah terionisasi sebagian (tidak semua terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.6 Basa Kuat dan Reaksi Ionisasinya
Tabel 1.7 Beberapa Basa Lemah dan Reaksi Ionisasinya
D. Garam
Dalam kehidupan sehari-hari kita mengenal garam dapur yang biasa digunakan untuk bumbu masak. Garam dapur merupakan salah contoh dari garam menurut ilmu kimia.
Seperti halnya asam dan basa, garam juga memiliki peranan yang sangat penting dalam kehidupan. Perhatikan tabel berikut.
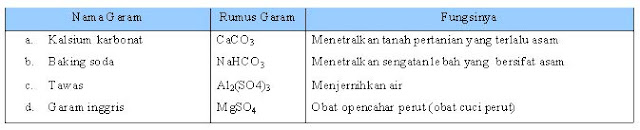
Tabel 1.8 Beberapa Garam dan Fungsinya dalam Kehidupan Sehari-Hari
Adapun ciri-ciri dari garam antara lain:
1. Dalam bentuk leburan (cairan) atau lelehan dapat menghantarkan listrik
2. Sifat larutannya dapat berupa asam, basa, atau netral tergantung jenis asam (kuat atau lemah) dan basa (kuat atau lemah) pembentuknya.
a. asam kuat dan basa kuat akan terbentuk garam yang bersifat netral
b. asam kuat dan basa lemah akan terbentuk garam yang bersifat asam
c. asam lemah dan basa kuat akan terbentuk garam yang bersifat basa
E. E. Tingkat Keasaman (pH)
Tingkat keasaman merupakan ukuran besar kecilnya pH yang menunjukkan skala keasaman dan kebasaan suatu larutan, angkanya sekitar 0 sampai dengan 14 dengan ketentuan sebagai berikut.
1. Larutan asam memiliki pH<7
2. Larutan basa memiliki pH>7
3. Larutan netral memiliki pH=7
F. Indikator
Indikator adalah bahan/alat yang digunakan untuk mengenali sifat suatu senyawa (asam, basa atau netral).
Macam-macam Indikator:
Macam-macam Indikator:
1. Indikator alami
Indikator alami diperoleh dari bagian tumbuhan berwarna dapat berupa bunga, daun, buah, biji, atau akarnya. Contohnya, kunir, bunga sepatu merah, kulit manggis, dan lain-lain.
Misalkan kulit manggis, kulitnya digerus sampai halus kemudian dituangi pelarut (alkohol) dan selanjutnya airnya dipisahkan melalui penyaringan. Ekstrak kulit manggis tersebut di teteskan pada senyawa yang bersifat asam atau basa, contohnya adalah larutan asam (HCl) atau basa (NaOH), maka:
- Pada larutan asam : terjadi perubahan warna dari ungu menjadi coklat kemerahan
- Pada larutan basa: terjadi perubahan warna dari ungu menjadi biru kehitaman
2. Indikator buatan
a. Kertas lakmus
b. Kertas indikator universal
c. Larutan
Tabel 1.10 Beberapa Indikator Larutan dan Perubahan Warnanya
d. pH meter/pH digital
G. Reaksi pada Asam, Basa, dan Garam
- Logam + asam -------> gas hidrogen + garam
Contoh: besi + larutan asam asetat ----------> gas hidrogen + besi(II) asetat
Fe(s) +2CH3COOH ----------> H2(g) +Fe( CH3COO)2(aq)
- Asam kuat + basa kuat ---------> garam (bersifat netral) + air
Contoh: Larutan asam klorida + larutan natrium hidroksida ---> larutan natrium klorida + air
HCl(aq) + NaOH(aq) ---> NaCl(aq) + H2O(l)
- Asam lemah + basa kuat ---> garam (bersifat basa) + air
Contoh: Larutan asam phosfat + larutan natrium hidroksida --> larutan natrium phosfat + air
H3PO4(aq) + 3NaOH(aq) --> Na3PO4(aq) + 3H2O(l)
- Basa lemah + asam kuat --> garam (bersifat asam) + air
Contoh: Larutan ammonium hidroksida + larutan asam sulfat --> larutan ammonium sulfat + air
2NH4OH(aq) + H2SO4(aq) --> (NH4)2 SO4(aq) + 2H2O(l)
- Oksida logam (oksida basa) + asam --> garam + air
Contoh: natrium oksida + larutan asam nitrat --> larutan natrium nitrat + air
Na2O(s) + HNO3(aq) ---> NaNO3(aq) + H2O(l)
- Oksida nonlogam (oksida asam) + basa ---> garam + air
Contoh: gas karbon dioksida + larutan kalsium hidroksida --> endapan kalsium karbonat + air
CO2(g) + Ca(OH)2(aq) ---> CaCO3(s) + H2O(l)
Judul artikel: Asam, Basa, dan Garam.
Anda boleh mengcopy artikel ini jika bermanfaat, jangan lupa mencantumkan url dibawah sebagai sumbernya.
URL: http://memetmulyadi.blogspot.com/2012/04/asam-basa-dan-garam.html
Terimakasih atas kunjungan anda.















mkasiii.,.,. ternyata tgas aku lengkap smua dsinii :D
BalasHapusMudah-mudahan bermanfaat. Trims atas kunjungannya :)
Hapusmksii bngt ya... untung ada yg sprti ini
BalasHapusmakasih atas info'a...pr ku jadi bisa diselesaikan.
BalasHapusmakasih atas info'a.....pr ku jdi bisa diselesaikan
BalasHapuspengen dong dijelasin juga reaksi asam sitrat dan asam askrobat ??
BalasHapus:D
makasih yha infony klw ga ad info q ga bsa jwb tugas q
BalasHapus@Bagoes11: Ya... sama-sama... :)
BalasHapus@venny sta: makasih... syukurlah klo bermanfaat.. :)
@novianti nurlaila: Akan saya coba posting berikutnya...
@ratrie kurniasari: siip... :)
thanks yaaa
BalasHapusthanks yaa,,,
BalasHapussangat membantu... :)
thanks ..
BalasHapusit's really help me.. :)
Geoffrey Gregory. 19 Agustus 2013
BalasHapusTrima kasi,info ini sangat membantu saya.
@adwidya prastut, @benteng galung, @Anonim: Oke sama2 trims...:)
BalasHapusthanks for your information but your information less complete please
BalasHapusI'll fill again at steady
wah thx yaa tapi... kurang lengkap nih... thx ya =D
BalasHapusthx y tapi kurang materi nya
BalasHapusthx y tapi kurang materi nya
BalasHapusINI,blog bagus benar semua nya lengkap di blog in makasih ya......
BalasHapusthanks za infonya Bermanfaat bgt.
BalasHapusthanks yy
BalasHapusgak jelas -_-
BalasHapusgax jelas
BalasHapusApanya yang gak jelas, lo kali yang gak jelas(rizqillah luffy)
BalasHapusmakasih ya!! infonya sangat membantu (y)
BalasHapusHmu aoung ztu sahio youtng haeih?
BalasHapusPerkenalkan, saya dari tim kumpulbagi. Saya ingin tau, apakah kiranya anda berencana untuk mengoleksi files menggunakan hosting yang baru?
BalasHapusJika ya, silahkan kunjungi website ini www.kbagi.com untuk info selengkapnya.
Di sana anda bisa dengan bebas share dan mendowload foto-foto keluarga dan trip, music, video, filem dll dalam jumlah dan waktu yang tidak terbatas, setelah registrasi terlebih dahulu. Gratis :)